2. Applications des bactériophages en santé humaine
Applications des bactériophages en médecine humaine
Actuellement, la prévalence croissante des infections causées par des bactéries multi-résistantes est inquiétante comme le souligne un rapport récent de l’Organisation Mondiale de la Santé. Il est ainsi devenu urgent de développer de nouvelles stratégies anti-infectieuses. Si l’utilisation des bactériophages comme agents antibactériens n’est pas une solution universelle, elle est réaliste tant en termes économiques que temporels. À la lumière des connaissances fondamentales obtenues au cours de plus de 100 années de recherche, des approches médicales et scientifiques rigoureuses se mettent aujourd’hui en place pour lever les derniers obstacles à la réintroduction de la phagothérapie en médecine humaine dans les pays ayant oublié ou négligé cette approche thérapeutique.
Bien que les bactériophages aient été les premiers agents spécifiquement antibactériens proposés à partir de 1917 par Félix d’Hérelle [14], le destin thérapeutique des bactériophages s’est heurté à plusieurs erreurs historiques qui leur ont jeté un fort discrédit de manière pourtant fortuite : ainsi, au début du siècle (1920-1940), les bactériophages étaient produits selon des standards différents de ceux d’aujourd’hui avec d’importants problèmes concernant qualité et quantité du produit fini, conduisant à la commercialisation de préparations dont l’efficacité était variable voire nulle [15]. De plus, les indications retenues à l’époque n’étaient pas toujours fondées (on pouvait par exemple utiliser des préparations de bactériophages réputées traiter certaines infections que l’on sait maintenant causées par le virus herpès [16]. De même, l’utilisation de certaines préparations n’était pas toujours appropriée du fait d’une méconnaissance de l’écologie bactérienne impliquée (ce qui arrive encore également de nos jour avec la prescription d’antibiotiques dans le cadre d’infection non systématiquement bactériennes [17]). Enfin, la forte spécificité des bactériophages est un de leur avantage majeur (respect du microbiote, absence d’acquisition de résistance chez les souches non ciblées) mais constitue en même temps l’un des points les plus contraignant (pour choisir les ou les bactériophages actifs il demeure nécessaire d’isoler l’agent étiologique, de tester sa sensibilité par un « phagogramme » puis de produire la préparation thérapeutique). Toutes ces étapes rendent la phagothérapie plus contraignante par comparaison à l’administration d’antibiotiques à large spectre. Malgré la découverte de nombreux nouveaux antibiotiques, la production de bactériophages thérapeutiques a perduré jusqu’à la fin des années 1970 en France (Figure 1) où plusieurs préparations étaient inscrites dans le dictionnaire Vidal.

Figure 1. Photographie d’une boite d’ampoules contenant une solution de bactériophages produite en France par un laboratoire dirigé par F. d’Hérelle. On notera l’inscription qui stipule « Délivré gratuitement pour des expériences de traitement, ne peut faire l’objet de transaction commerciale » laissant supposer que ces ampoules n’étaient pas commercialisées.
La phagothérapie consiste en l’application de bactériophages dits « virulents » (i.e. ne réalisant qu’un cycle lytique, sans cycle lysogénique, qui est une caractéristique des bactériophages dits « tempérés ») pour le traitement d’une infection bactérienne. Même si aucun obstacle conceptuel ne s’oppose à l’action théorique des bactériophages quel que soit le type d’infection, certaines considérations pratiques en limitent l’applicabilité. Par exemple, les méningites, par l’existence de la barrière hémato-encéphalique qui impose déjà une forte majoration des posologies d’antibiotiques, constituent des infections dont la prise en charge thérapeutique par des bactériophages n’apparaît pas prioritaire en termes de balance bénéfice-risque, même si elle s’est révélée expérimentalement efficace chez le rat nouveau-né [18]. Inversement, la capacité des bactériophages à augmenter leur concentration au site infectieux suite à leur réplication au dépend de l’agent pathogène en fait des alliés particulièrement intéressants dans les infections où les antibiotiques diffusent mal : infections osseuses ou articulaires, matériel prothétique, infections de type abcès, empyèmes, etc (Wills-2005, Hung -2011, capparelli-2007).
Le caractère aigu ou chronique (cinétique intrinsèque) et la morbidité-mortalité de l’infection sont des paramètres déterminant pour l’application (ou non) de la phagothérapie. Ainsi, dans la plupart des infections chroniques, la bactérie responsable est connue et le pronostic vital des patients n’est généralement pas engagé en termes d’heures ou de jours. Il est alors possible d’adopter une approche personnalisée « sur mesure » (voir ci-dessus). Inversement, la phagothérapie sur mesure n’est pas recommandée dans le cas des infections aiguës menaçant le pronostic vital, puisqu’on souhaite un traitement efficace le plus rapidement possible alors que la plupart du temps, la bactérie responsable n’est pas encore identifiée. Par ailleurs, dans la mesure où les bactériophages n’infectent que des cellules bactériennes, la phagothérapie est d’un recours limité pour les bactéries pathogènes ayant un développement exclusivement intracellulaire (par exemple Coxiella burnetii, Chlamydia spp, Rickettsia spp, Tropheryma whipplei) et/ou à croissance intracellulaire facultative (par exemple Legionnella pneumophila, Bartonella spp, Brucella melitensis, Helicobacter pylori).
La modélisation de la pharmacocinétique des bactériophages nécessite de prendre en compte de nombreux paramètres liés à leur cycle viral, tels que la constante d’adsorption des virus sur les bactéries hôtes, le nombre de virions libérés par cycle, le temps de latence, la quantité de bactéries initiales et le ratio bactériophage/bactérie (on parle de multiplicité d’infection). De même, la densité bactérienne minimale pour assurer un amorçage de la multiplication/transmission virale doit être connue : par analogie on sait que certaines maladies virales humaines introduites dans une zone peu peuplée auront une probabilité d’émergence plus faible que si elles sont introduites dans un environnement urbain, avec comme conséquence une extinction précoce de l’épidémie par défaut de relais. La modélisation se complexifie encore lorsque l’on prend en compte la dynamique de la population bactérienne au cours du temps (les cellules non infectées continuant à se répliquer) ainsi que les phénomènes de résistance aux bactériophages et d’amplification de ceux-ci au cours du traitement [19]. Cette pharmacocinétique si particulière n’est que peu abordée dans les études expérimentales animales, typiquement en raison de sa complexité (détermination des constantes virales in vivo, inoculum bactérien, constante d’élimination virale spontanée, etc.). Il s’agit cependant d’une approche fondamentalement importante et qui, faute d’avoir été prise en compte, pourrait expliquer un certain nombre d’échecs antérieurs de la phagothérapie [20]. La modélisation théorique de la pharmacocinétique a ainsi permis de corréler positivement et significativement les résultats prédits avec ce qui est observé in vitro [21] mais difficilement in vivo [22], prouvant la nécessité de poursuivre les études dans ce domaine.
Chez les mammifères (humains comme animaux), la mise en contact d’un virus avec les tissus (par voies cutanée, orale, respiratoire ou intraveineuse) est à même de provoquer une réaction immunitaire, potentiellement délétère pour l’hôte. Toutefois, de manière singulière, les bactériophages ne semblent pas provoquer d’effet toxique [23]. En effet, ces particules virales sont largement présentes dans divers microbiotes avec lesquels les mammifères sont en interactions permanentes, comme par exemple l’intestin [24, 25].
L’innocuité des bactériophages a ainsi pu être démontrée dans différentes études. Au plan expérimental en premier lieu, des études réalisées in vivo (modèle murin) et ex vivo (sur cellules dentritiques), ont montré que le bactériophage T4 administré par voie intra-péritonéale (T4 entier ou ses protéines majeures de capside) n’a pas induit la production de cytokines de la phase aiguë. Mis au contact de cellules dendritiques le bactériophage T4 ne provoque pas la production d’espèces réactives de l’oxygène (ROS) [26]. Enfin, une activité immunomodulatrice des bactériophages a été proposée mais sa pertinence demande à être vérifiée in vivo [27]. Une étude récente a montré que l’administration par voie pulmonaire de 2 coliphages chez des souris infectées ou non par des souches pathogènes d’E. coli n’entrainait pas de synthèse significative des cytokines de la phase aiguë de l’inflammation (Il-1b, Il-6, TNFa, KC notamment) par rapport aux souris ayant reçu le solvant ou un traitement antibiotique de référence [28].
Chez l’homme, on peut par exemple mentionnerl’Institut Ludwik Hirszfeld en Pologne qui a suivi des patients (n=157 sur 3 ans) présentant différentes infections à germe multi-résistants notamment urinaires, osseuses ou respiratoires) et traités par phagothérapie pendant plusieurs semaines. Unsuivi biologique de différents paramètres (numération-formule sanguine, bilan hépatique, fonction rénale et protéine C réactive) a été réalisé après le début du traitement et comparée à la situation avant traitement. Aucune variation cliniquement pertinente de ces paramètres n’a été observée chez ces patients démontrant l’innocuité des bactériophages dans ces conditions [29]. De manière similaire, aucun des volontaires (n=15) ayant réalisé trois prises orales par jour pendant deux jours du bactériophage T4 ciblant E. coli n’a présenté d’effets indésirables, ni d’élévation des marqueurs de cytolyse hépatique ni même développé d’anticorps dirigés contre le bactériophage T4 lors d’analyses réalisées à la fin de la période d’observation [30]. Notons que cette innocuité des bactériophages ne se limite pas au phage T4, mais a aussi été montré avec d’autres applications, voire par exemple l’ingestion de cocktail commerciaux par voie orale [31].
De nombreux cas de patients traités par phagothérapie ont également été rapportés dans la littérature, non obligatoirement centré sur la question de l’innocuité, mais n’ont pas mis en évidence de problème de tolérance, alors même que l’administration de bactériophages était réalisée par voie intraveineuse [32-37].
Outre leur innocuité, l’administration des bactériophages est à même de générer la formation d’anticorps spécifiques. Historiquement, le bactériophage φX174 (un microviridae infectant E. coli) a été utilisé à partir des années 1960 chez l’homme, en injection intraveineuse, pendant plus de 30 ans, afin d’induire et quantifier une réponse immunitaire en dosant la présence d’anticorps spécifiques à ce bactériophage [38-40]. On signalera par ailleurs qu’aucun effet secondaire sérieux n’a été rapporté chez ces patients qui recevaient par voie intraveineuse des doses de 2.109 particules virales (PFU) par kg de poids corporel, générant des concentrations plasmatiques post-injection de l’ordre de 5.107 PFU/mL (3 injections au total, espacées de 6 semaines, étaient réalisées). Les patients immunocompétents développaient tous un schéma de réponse normale avec synthèse d’immunoglobulines de type IgM puis IgG de forte affinité. Ces anticorps possédaient un pouvoir neutralisant envers le bactériophage φX174. Des résultats similaires ont été observés avec le bactériophage T4 [41]. Cependant, cette production d’anticorps n’est pas toujours synonyme d’inactivation virale puisque les anticorps produits peuvent être non neutralisants, n’entravant pas le pouvoir infectieux du bactériophage [42].
Enfin, une étude récente permet de poser la question de l’efficacité de la phagothérapie en fonction de l’état immunitaire de l’hôte. C’est pour répondre à cette question que la variation de l’immunocompétence de l’hôte a été étudiée dans un modèle murin d’infection respiratoire [43]. Les auteurs ont pu montrer que les souris immunocompétentes survivent à une infection létale grâce au traitement par un bactériophage, tandis que des souris immunodéprimées ne survivent pas plus qu’en l’absence de traitement par bactériophage. Plus précisément, l’échec de la phagothérapie chez les souris immunodéprimées semble être dû à l’absence de neutrophiles qui limitent, chez les animaux immunocompétents, la croissance des bactéries devenues résistantes au bactériophage utilisé (Figure 2). Ces travaux montrent bien la synergie entre le système immunitaire et les bactériophages et la nécessité des prendre en considération les interactions tripartites entre bactériophages, bactéries et cellules immunitaires pour contrôler au mieux l’application des traitements.
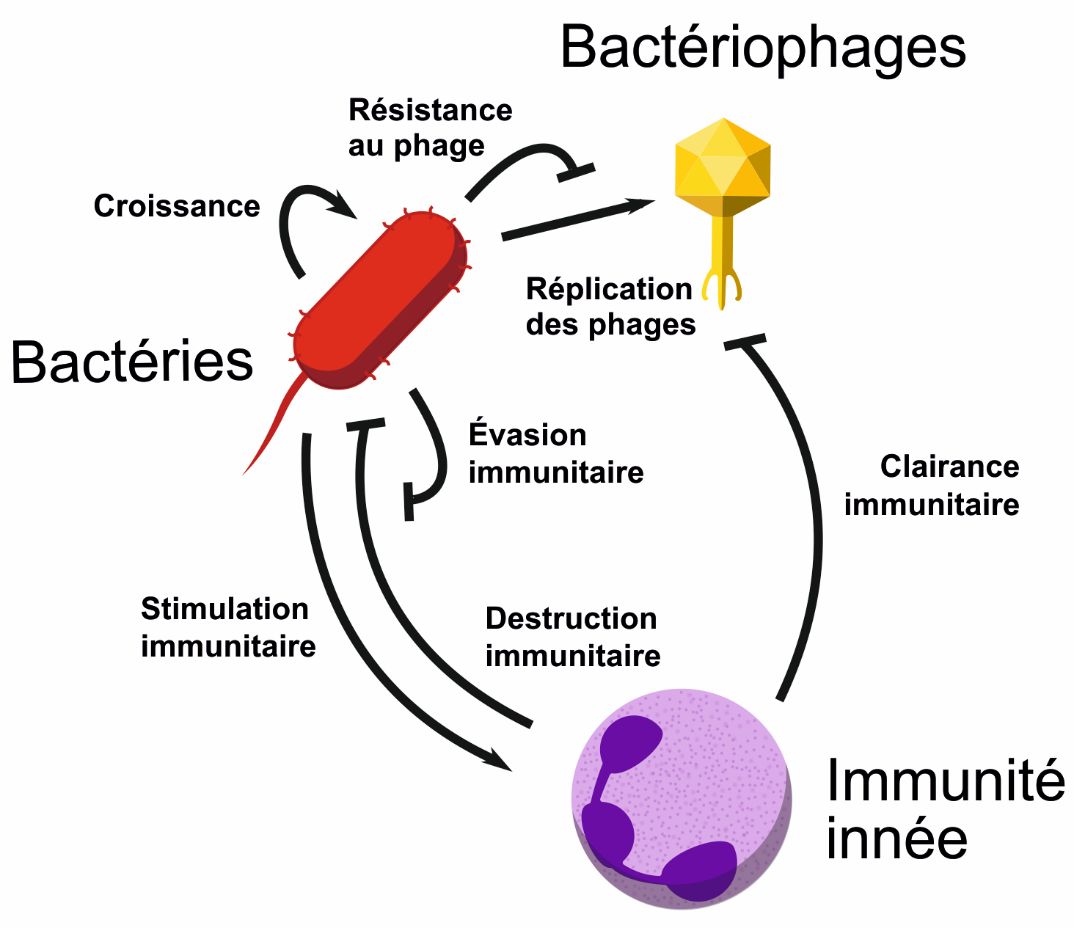
Figure 2. Représentation schématique des interactions multiples entre bactériophages, bactéries et cellules de l’immunité innée prenant place au cours d’une phagothérapie pulmonaire (adapté de [43]).
Lors d’un traitement antibactérien par molécule chimique ou par phagothérapie, les bactéries lysées peuvent induire une réaction immunitaire aigüe par le relargage d’une quantité importante de molécules immunogènes (endo- et exotoxines, ADN bactérien). Plus précisément, chez les bactéries à Gram positif, il s’agit des acides lipoteichoïques et du peptidoglycane principalement, et chez les bactéries à Gram négatif du lipopolysaccharide (notamment sa fraction lipidique : le lipide A ou endotoxine). Récemment, une étude comparative entre antibiotiques et bactériophages a permis de montrer que le taux d’endotoxine libéré par l’action des bactériophages est bien inférieur à celui obtenu avec des -lactamines couramment utilisées en clinique [44]. Mieux, les bactériophages et les antibiotiques peuvent être utilisés de manière complémentaire, et ce, pour diminuer l’apparition de génotypes bactériens résistants à l’un ou l’autre traitement [45, 46].
Ainsi, quatre situations pratiques peuvent être schématiquement envisageables. i) L’infection est aiguë et sévère, liée à un germe ne posant pas de problème connu d’antibiorésistance où une antibiothérapie conventionnelle est envisageable : dans ce cas la phagothérapie n’est pas pertinente ; ii) L’infection est sévère ou non, mais causée par une bactérie multi-résistante dont la prise en charge par des antibiotiques de référence est impossible, conduisant à l’utilisation d’antibiotiques moins actifs ou non validés ou présentant des effets secondaires indésirables (e.g. insuffisance rénale liée à l’usage de la colistine) : un co-traitement par antibiotiques et bactériophages est pertinent. Dans ce cas, peu de données existent concernant la temporalité optimale d’utilisation de ces deux traitement anti-infectieux (co-administration, antibiotiques puis bactériophages ou l’inverse). Certains auteurs ont ainsi pu démontrer l’importance d’une séquentialité (phages puis antibiotiques) dans le control bactérien et l’apparition de bactéries résistantes aux antibiotiques [47]. Par ailleurs, il existe un nombre croissant de publications qui font état d’un effet synergique fort entre ces deux thérapeutiques, notamment en présence de concentrations sub-inhibitrices d’antibiotiques (situation fréquente en cas de résistance ou en fin de traitement ou encore de mauvais usage). Par un mécanisme mal élucidé, l’utilisation simultanée d’antibiotique majore le pouvoir lytique des bactériophages avec notamment une augmentation de la quantité de virions libérés [48-51]. D’autres travaux ont également mis en évidence une synergie en termes de diminution de la résistance au virus et à l’antibiotique. Par exemple, au cours d’un traitement compassionnel, Chan et al., ont utilisé un bactériophage anti-pseudomonas dont le récepteur bactérien est une protéine d’efflux impliquée dans l’efflux de certains antibiotiques (et donc leur résistance) [32]. Pour la bactérie, un des mécanismes de résistances au phage est une mutation (ou diminution de l’expression) de ce récepteur-pompe, laquelle va aboutir à une perte de cette fonction d’efflux, restaurant alors une sensibilité à l’antibiotique. iii) L’infection est causée par un germe responsable d’une infection bénigne et chronique pour laquelle le traitement antibiotique n’apparaît pas pertinent, contre indiqué (allergie) ou peu efficace (problème de diffusion, résistance, colonisation chronique) :le traitement peut alors être envisagé exclusivement par la phagothérapie. Il s’agit typiquement des infections cutanées (furonculose, infection du pied chez le patient diabétique, folliculite, impétigo peu étendu par exemple) [34] ou de la sphère ORL (otites chroniques par exemple) [52]. iv) Il n’y a pas d’infection mais une situation de colonisation par un pathogène (à même de provoquer secondairement une infection). On peut notamment inclure les colonisations urinaires (à l’origine des cystites chroniques), les colonisations bronchiques (mucoviscidose et dilatation de bronches, en dehors des décompensations), les colonisations à germes multi-résistants (digestives avec les entérobactéries ou cutanéomuqueuses avec les souches de S. aureus résistant à la méticilline), ou encore les colonisations oropharyngées des patients sous ventilation mécanique. Le propos d’une phagothérapie est ici de cibler le réservoir bactérien, de réaliser une épargne antibiotique et d’exercer une action essentiellement prophylactique. À ce jour, le nombre de cas individuels traités avec succès par bactériophages augmente rapidement dans le monde [32, 35, 37], mais peu d’études cliniques conduites selon la méthodologie de référence (étude en double aveugle, randomisée et contrôlée contre placebo ou traitement de référence) ont été publiées [53]. Ce faible nombre d’essais cliniques et la qualité variable des publications rapportant les cas individuels rendent ainsi difficile l’interprétation des résultats et diminuent la robustesse des conclusions. Néanmoins, nous rappellerons brièvement les faits marquants issus des trois essais cliniques les plus récents.
Le premier a concerné l’efficacité thérapeutique des bactériophages dans les otites chroniques à P. aeruginosa multi-résistant [52] (essai contrôlé, en double aveugle, contre placebo). Le critère de jugement principal était clinique (évaluation des lésions par le médecin avec un score composite et évaluation par le patient de ses symptômes avec également un autre score). Le critère de jugement secondaire était le compte bactérien. Vingt-quatre patients ont été inclus (les patients présentant une infection à P. aeruginosa résistant au cocktail de 6 bactériophages étaient exclus). Le cocktail était administré localement par voie intra-auriculaire une unique fois à J0 avec un suivi à J7, J21 et J42. Les résultats de l’étude sont positifs sur les critères de jugement principal et secondaire avec cependant un effet antibactérien de faible amplitude (réduction du compte bactérien inférieure à un facteur 10).
La seconde étude (NCT00937274) a porté sur le traitement des diarrhées du jeune enfant (6 à 24 mois) à E. coli (souches entérotoxinogènes et entéropathogènes principalement) au Bangladesh. Cet essai randomisé contrôlé monocentrique a comparé une prise en charge thérapeutique par une solution de réhydratation orale (traitement commun) avec traitement oral par cocktail de bactériophages ou bien placebo [54]. Deux cocktails de phages étaient testés : un cocktail de 11 phages de type T4, issu de la recherche Nestlé et un cocktail commercial de la société Microgen. Le critère de jugement principal était la tolérance et l’innocuité du cocktail de phage. Le critère de jugement secondaire était la capacité du cocktail à s’amplifier dans les selles et à diminuer la quantité d’E. coli entérotoxinogènes. Le troisième critère de jugement était l’impact des cocktails sur le volume et la fréquence des selles ainsi que le volume d’hydratation nécessaire. Des analyses du microbiote fécal ont également été réalisées.
Cent vingt patients ont été inclus. Aucun effet secondaire attribuable aux cocktails n’a été mise en évidence (évaluation clinique et biologique sur des paramètres rénaux, hépatiques et hématologiques). Les cocktails se sont révélés inefficaces sur le plan clinique (critère de jugement tertiaire). En prenant en compte la quantité de phage administré, il n’a pas été observé d’amplification significative des phages des deux cocktails dans les selles, même chez les patients porteurs de souches d’E. coli sensibles aux phages administrés. Aucune diminution significative de la quantité d’E. coli entérotoxinogène dans les selles n’a été mise en évidence chez les patients traités par phages. La négativité de cet essai peut a posteriori s’expliquer en partie par une prévalence plus faible qu’attendue d’infection à E. coli entéropathogène (60% des 120 patients inclus seulement) et par un titre bactérien faible dans les selles, ne permettant pas de soutenir une réplication virale des bactériophages administrés. D’autre part, seulement 50% des patients présentaient des souches d’E. coli sensibles aux cocktails, avec une corrélation positive entre symptômes (diarrhées) et quantité de germes du genre Streptococcus dans les selles (analyse du microbiote fécal) soulevant la question de l’agent causal réel de ces diarrhées [55]. Enfin, l’administration des phages se faisait sans neutralisation du pH gastrique, ce qui a pu conduire à une destruction importante des virus administrés et donc une biodisponibilité très réduite en aval de l’estomac.
L’étude la plus récente (non aveugle, randomisée, contrôlée), dénommée PhagoBurn (NCT02116010), a évalué l’effet de l’application locale d’un cocktail de 12 bactériophages ciblant P. aeruginosa (infections monogermes) sur les complications infectieuses des plaies de patients brûlés, comparé à la sulfadiazine argentique (traitement antiseptique local de référence) [12]. Le critère de jugement principal était le délai de réduction de l’inoculum bactérien par une méthode semi-quantitative (écouvillonnage quotidien de la plaie et dénombrement sur milieu gélosé). Vingt-sept patients ont été inclus (13 traités par le cocktail de bactériophages, 14 par la sulfadiazine argentique) au cours d’une période de 13 mois. Cet essai s’est révélé négatif, avec une efficacité significativement moindre du cocktail de bactériophages. Aucun effet indésirable n’a été mis en évidence chez les patients traités par bactériophages. Une analyse effectuée a posteriori a révélé une diminution majeure du titre de bactériophages dans les lots thérapeutiques, aboutissant à une application très réduite du nombre de bactériophages sur les plaies (concentration finale active observée autour de 10^2 PFU/mL comparée à une concentration attendue d’au moins 106 PFU/mL). De plus, certaines souches bactériennes isolées des patients présentaient une sensibilité intermédiaire voire une résistance au cocktail de bactériophages.
Notons toutefois que d’autres essais cliniques sont en préparation en France, en Europe et aux Etats-Unis, s’appuyant sur des start-ups (e.g. Pherecydes Pharma en France, Vésale Pharma en Belgique, Armata Pharmaceuticals aux Etats-Unis), ce qui apportera rapidement de nouveaux résultats permettant : (1) de mieux définir les indications thérapeutiques, (2) de tenir compte des écueils passés et ne pas négliger les paramètres propres à la pharmacodynamie, pharmacocinétiques et galénique optimale des préparations de bactériophages, (3) de mieux définir la place d’une stratégie « prêt-à-porter » (cocktail de phages générique et fixe) comparée à une stratégie « sur mesure » (un ou plusieurs phages spécifiquement sélectionnés pour cibler la bactérie causale). Enfin signalons qu’aux Etats-Unis, dans l’état de Californie, un centre de référence a été récemment créé (juin 2018), avec pour objectif de centraliser et répondre aux demandes de traitement compassionnels par phagothérapie (Center for Innovative Phage Applications and Therapeutics, IPATH). Cette structure, basée à San Diego et sous la responsabilité de la faculté de médecine, se positionne également comme un acteur clé visant à promouvoir les échanges entre partenaires industriels et institutionnels, dans un objectif thérapeutique premier.